Kanker saluran empedu atau kolangiokarsinoma (cholangiocarcinoma) merupakan keganasan yang berasal dari sel epitel saluran empedu, sistem pembuluh yang mengalirkan cairan empedu dari hati menuju usus halus. Meskipun tergolong kanker langka dengan insidensi global sekitar 1-2 kasus per 100.000 penduduk per tahun, penyakit ini memiliki tingkat keganasan tinggi dan prognosis yang umumnya buruk. Karakteristik khas kolangiokarsinoma adalah diagnosis yang sering terlambat karena gejala awal yang tidak spesifik, serta lokasi anatomis yang kompleks membuat penanganan bedah menjadi menantang.
Dalam dua dekade terakhir, terjadi peningkatan insidensi kolangiokarsinoma di berbagai belahan dunia, termasuk Asia Tenggara. Wilayah ini memiliki prevalensi tinggi karena endemisitas infeksi parasit hati tertentu dan faktor risiko lingkungan lainnya. Pemahaman mendalam tentang faktor risiko, mekanisme karsinogenesis, pendekatan diagnostik terkini, serta modalitas terapi yang terus berkembang menjadi penting bagi tenaga kesehatan dan masyarakat umum untuk meningkatkan deteksi dini dan hasil pengobatan.
- Klasifikasi dan Epidemiologi
- Faktor Risiko dan Patogenesis
- Manifestasi Klinis
- Pendekatan Diagnostik
- Modalitas Pengobatan
- Prognosis dan Survival
- Strategi Pencegahan dan Deteksi Dini
- Perspektif Regional Indonesia
- Kesimpulan
- Referensi
Klasifikasi dan Epidemiologi
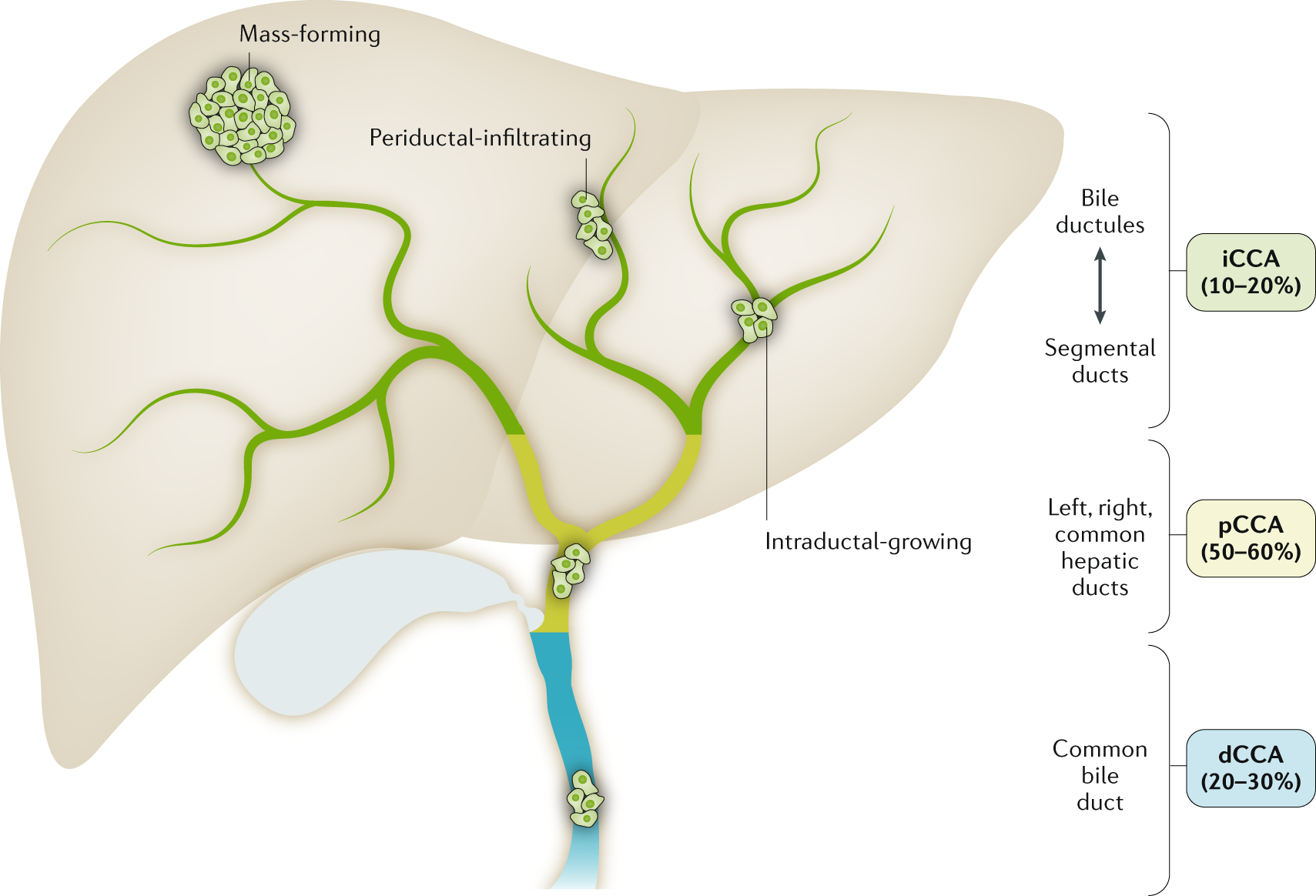
Kolangiokarsinoma diklasifikasikan berdasarkan lokasi anatomis menjadi tiga kategori utama: kolangiokarsinoma intrahepatik (intrahepatic cholangiocarcinoma/iCCA) yang timbul dari saluran empedu kecil di dalam parenkim hati, kolangiokarsinoma perihilar atau tumor Klatskin yang terjadi pada pertemuan duktus hepatikus kanan dan kiri, serta kolangiokarsinoma distal yang melibatkan saluran empedu ekstrahepatik bagian bawah. Klasifikasi ini penting karena menentukan pendekatan terapi dan prognosis pasien.
Secara global, kolangiokarsinoma menyumbang sekitar 3% dari seluruh keganasan saluran cerna dan 10-15% dari kanker hati primer. Distribusi geografis menunjukkan variasi signifikan, dengan insidensi tertinggi ditemukan di Asia Tenggara, khususnya Thailand yang melaporkan angka hingga 96 per 100.000 penduduk di area endemik infeksi cacing hati. Di Indonesia, data epidemiologi spesifik masih terbatas, namun beberapa studi rumah sakit menunjukkan kasus kolangiokarsinoma mewakili 5-10% dari seluruh keganasan hepatobilier yang terdiagnosis.
Penelitian epidemiologi terkini menunjukkan tren peningkatan insidensi kolangiokarsinoma intrahepatik di negara-negara Barat selama 30 tahun terakhir, sementara angka kolangiokarsinoma ekstrahepatik cenderung stabil atau menurun. Pola ini dikaitkan dengan perubahan prevalensi faktor risiko, peningkatan teknik diagnostik pencitraan, serta kemungkinan reklasifikasi diagnosis dari kanker hati primer lainnya. Distribusi usia menunjukkan puncak insidensi pada dekade keenam dan ketujuh kehidupan, dengan rasio pria dibanding wanita berkisar 1,2-1,5:1.
Faktor Risiko dan Patogenesis
Patogenesis kolangiokarsinoma melibatkan interaksi kompleks antara inflamasi kronik saluran empedu, stasis bilier, dan paparan karsinogen yang memicu akumulasi mutasi genetik pada sel epitel saluran empedu (cholangiocyte). Inflamasi kronik berulang menyebabkan proliferasi sel kompensatorik, stres oksidatif, dan produksi sitokin proinflamasi yang menciptakan lingkungan mikro kondusif bagi transformasi maligna. Proses karsinogenesis ini berlangsung bertahap melalui sekuensi displasia-karsinoma yang dapat memakan waktu dekade.
Faktor risiko utama kolangiokarsinoma mencakup kondisi yang menyebabkan kolestasis dan inflamasi bilier kronik. Primary sclerosing cholangitis (PSC), penyakit autoimun yang menyebabkan fibrosis progresif saluran empedu, merupakan faktor risiko terkuat di negara Barat dengan risiko seumur hidup 10-20% untuk berkembang menjadi kolangiokarsinoma. Infeksi parasit hati, khususnya Opisthorchis viverrini dan Clonorchis sinensis yang endemik di Asia Tenggara, juga meningkatkan risiko hingga 5-6 kali lipat melalui mekanisme inflamasi kronik dan produksi toksin parasit.
Kelainan kongenital sistem bilier seperti kista duktus koledokus dan penyakit Caroli meningkatkan risiko kolangiokarsinoma hingga 15-20% selama hidup penderita. Hepatolitiasis atau batu empedu intrahepatik yang umum di Asia Timur, sirosis hati berbagai etiologi, hepatitis B dan C kronik, serta obesitas dan diabetes melitus merupakan faktor risiko tambahan yang perlu dipertimbangkan. Paparan lingkungan terhadap thorotrast (kontras radiologi yang sudah ditinggalkan), asbes, dioksin, dan nitrosamin juga dikaitkan dengan peningkatan insidensi.
Studi molekuler terkini mengidentifikasi berbagai jalur pensinyalan yang teraktivasi abnormal pada kolangiokarsinoma. Mutasi gen TP53, KRAS, SMAD4, dan ARID1A sering ditemukan, sementara amplifikasi ERBB2 (HER2) dan fusi gen FGFR2 menjadi target terapi potensial yang sedang dieksplorasi. Jalur inflamasi melibatkan aktivasi NF-κB, IL-6/STAT3, dan produksi berlebihan faktor pertumbuhan seperti VEGF yang mempromosi angiogenesis tumor. Perubahan epigenetik termasuk metilasi DNA dan modifikasi histon juga berperan dalam progresi penyakit.
Manifestasi Klinis
Presentasi klinis kolangiokarsinoma sangat bervariasi tergantung lokasi tumor, stadium penyakit, dan kecepatan pertumbuhan. Mayoritas pasien datang dengan gejala obstruksi bilier, terutama ikterus progresif yang merupakan gejala paling umum pada kolangiokarsinoma perihilar dan distal. Ikterus bersifat tidak nyeri, disertai urin berwarna gelap seperti teh pekat dan tinja berwarna pucat akibat berkurangnya ekskresi bilirubin ke usus. Pruritus atau gatal-gatal pada kulit akibat deposit garam empedu sering mendahului atau menyertai ikterus dan dapat sangat mengganggu kualitas hidup pasien.
Gejala konstitusional meliputi penurunan berat badan yang tidak disengaja, anoreksia, dan kelemahan umum yang mencerminkan beban penyakit sistemik. Nyeri perut kuadran kanan atas atau epigastrium terjadi pada sekitar 30-50% kasus, biasanya bersifat tumpul dan persisten. Demam dapat muncul pada 10-30% pasien, terutama jika terjadi kolangitis sekunder akibat obstruksi bilier. Hepatomegali atau teraba massa di hipokondrium kanan ditemukan pada pemeriksaan fisik, sedangkan asites dan tanda hipertensi portal mengindikasikan penyakit lanjut dengan sirosis atau metastasis peritoneal.
Kolangiokarsinoma intrahepatik memiliki presentasi berbeda karena tidak menyebabkan obstruksi bilier segera. Pasien sering asimtomatik pada stadium awal, dengan tumor ditemukan secara insidental pada pencitraan atau saat investigasi peningkatan enzim hati. Gejala muncul ketika tumor sudah besar atau bermetastasis, mencakup nyeri perut, distensi abdomen, atau gejala paraneoplastik seperti hiperglikemia. Keterlambatan diagnosis ini menjelaskan prognosis yang umumnya lebih buruk dibandingkan kolangiokarsinoma ekstrahepatik yang lebih cepat bergejala.
Sindrom paraneoplastik jarang namun dapat terjadi, termasuk trombosis vena dalam akibat hiperkoagulabilitas terkait kanker, dermatomiositis, atau hiperkolesterolemia. Pada stadium lanjut, manifestasi metastasis ekstrahepatal seperti nyeri tulang pada metastasis skeletal, sesak napas pada metastasis paru, atau gejala neurologis pada metastasis otak dapat mendominasi gambaran klinis.
Pendekatan Diagnostik
Diagnosis kolangiokarsinoma memerlukan kombinasi evaluasi klinis, pemeriksaan laboratorium, modalitas pencitraan canggih, dan konfirmasi histopatologi atau sitologi. Pendekatan diagnostik dimulai dengan anamnesis menyeluruh mengenai faktor risiko dan gejala, diikuti pemeriksaan fisik untuk mengidentifikasi tanda-tanda obstruksi bilier dan penyakit sistemik. Diagnosis pasti membutuhkan integrasi temuan dari berbagai modalitas karena tidak ada single test yang memiliki sensitivitas dan spesifisitas sempurna.
Pemeriksaan laboratorium awal mencakup fungsi hati lengkap yang menunjukkan pola kolestasis dengan peningkatan bilirubin direk, alkali fosfatase, dan gamma-glutamyl transferase (GGT) yang menonjol dibanding transaminase. Peningkatan CA 19-9 (carbohydrate antigen 19-9) ditemukan pada 85-95% kasus kolangiokarsinoma dengan nilai ambang >100-129 U/mL memiliki sensitivitas 53-89% dan spesifisitas 54-98%. Namun, CA 19-9 juga meningkat pada berbagai kondisi benigna seperti kolangitis, pankreatitis, atau obstruksi bilier dari penyebab lain, sehingga interpretasi harus hati-hati dalam konteks klinis.
Penelitian terkini mengeksplorasi biomarker baru seperti kombinasi CA 19-9 dengan CEA (carcinoembryonic antigen) atau penggunaan circulating tumor DNA (ctDNA) untuk meningkatkan akurasi diagnostik. Deteksi mutasi spesifik seperti IDH1, FGFR2 fusion, atau BRAF pada plasma dapat membantu diagnosis dan prediksi respons terapi target. Namun, pemeriksaan molekuler ini belum tersedia luas di Indonesia dan masih dalam tahap penelitian untuk validasi klinis.
Ultrasonografi (USG) abdomen merupakan modalitas pencitraan lini pertama yang non-invasif, mudah diakses, dan dapat mengidentifikasi dilatasi saluran empedu, massa intrahepatik, atau kelainan struktur bilier. Sensitivitas USG untuk mendeteksi kolangiokarsinoma berkisar 60-70%, dengan keterbatasan pada tumor kecil atau obesitas pasien. Doppler USG membantu mengevaluasi invasi vaskular yang penting untuk perencanaan bedah.
Computed tomography (CT) scan multiphasic dengan kontras merupakan gold standard pencitraan untuk staging kolangiokarsinoma, menyediakan informasi detail mengenai ukuran tumor, lokasi, ekstensi lokal, invasi vaskular, keterlibatan kelenjar getah bening, dan metastasis jauh. Protokol pencitraan triphasic (arterial, portal venous, delayed phase) mengoptimalkan karakterisasi lesi dengan pola progressive enhancement khas kolangiokarsinoma. CT juga mengevaluasi resektabilitas tumor dengan menilai hubungan dengan struktur vaskular mayor seperti vena porta dan arteri hepatika.
Magnetic resonance imaging (MRI) dengan magnetic resonance cholangiopancreatography (MRCP) memberikan visualisasi superior sistem bilier tanpa prosedur invasif. MRCP menggambarkan anatomi saluran empedu dengan detail tinggi, mengidentifikasi lokasi obstruksi, dan membedakan massa tumor dari striktur benigna. Diffusion-weighted imaging (DWI) meningkatkan deteksi tumor kecil dengan sensitivitas hingga 90%. MRI juga unggul dalam karakterisasi lesi hepar dan deteksi metastasis peritoneal kecil yang mungkin terlewat pada CT.
Endoscopic retrograde cholangiopancreatography (ERCP) berperan ganda sebagai modalitas diagnostik dan terapeutik. ERCP memungkinkan visualisasi langsung saluran empedu, pengambilan sampel sitologi melalui brushing atau biopsi, dan pemasangan stent bilier untuk dekompresi pada pasien dengan ikterus obstruktif. Sensitivitas sitologi brushing berkisar 30-60%, meningkat hingga 60-80% dengan kombinasi biopsi forceps. Teknik fluorescence in situ hybridization (FISH) atau digital image analysis pada sampel sitologi dapat meningkatkan akurasi diagnostik.
Endoscopic ultrasound (EUS) dengan fine needle aspiration (FNA) menawarkan akses biopsi langsung pada tumor perihepatik atau perihilar dengan sensitivitas 66-86% dan spesifisitas hingga 100%. EUS unggul dalam mengevaluasi kedalaman invasi tumor ke dinding duktus dan keterlibatan struktur sekitar. Pada kolangiokarsinoma distal, EUS membantu membedakan dari karsinoma kaput pankreas yang memiliki implikasi terapeutik berbeda.
Kolangioskopi peroral (POC) atau percutaneous transhepatic cholangioscopy memungkinkan visualisasi langsung mukosa saluran empedu dengan biopsi target under vision. SpyGlass digital cholangioscopy generasi terbaru meningkatkan sensitivitas diagnostik hingga 84-90% dengan kemampuan biopsi presisi. Modalitas ini terutama berguna pada kasus dengan sitologi ERCP negatif namun kecurigaan klinis tinggi.
Biopsi perkutan dengan panduan CT atau USG dapat dilakukan pada masa intrahepatik yang aksesibel, meskipun terdapat kontroversi mengenai risiko tumor seeding sepanjang jalur biopsi. Biopsi umumnya dihindari pada lesi yang berpotensi resektabel kecuali diagnosis mempengaruhi manajemen atau diperlukan untuk protokol kemoterapi neoadjuvan.
Staging kolangiokarsinoma menggunakan sistem TNM (Tumor-Node-Metastasis) edisi ke-8 American Joint Committee on Cancer (AJCC) yang berbeda untuk kolangiokarsinoma intrahepatik dan ekstrahepatik. Evaluasi staging komprehensif mencakup CT toraks untuk eksklusi metastasis paru, PET-CT untuk deteksi penyakit ekstrahepatal okult pada kandidat reseksi, serta laparoskopi staging pada kasus selektif untuk mendeteksi karsinomatosis peritoneal atau metastasis hepar kecil yang tidak terlihat pada pencitraan.
Modalitas Pengobatan
Terapi Bedah
Reseksi bedah komplit dengan margin negatif (R0) merupakan satu-satunya modalitas kuratif untuk kolangiokarsinoma, namun hanya 20-40% pasien memenuhi kriteria resektabilitas saat diagnosis. Kriteria resektabilitas mencakup tidak adanya metastasis jauh, tidak ada invasi vaskular mayor bilateral yang tidak dapat direkonstruksi, fungsi hati adekuat pada parenkim yang tersisa, dan kondisi umum pasien yang dapat mentolerir operasi mayor.
Untuk kolangiokarsinoma intrahepatik, hepatektomi mayor atau minor dengan margin minimal 1 cm merupakan standar. Reseksi anatomikal dengan limfadenektomi regional memberikan hasil onkologis superior dibanding reseksi non-anatomikal. Pada tumor besar atau bilateral, hepatektomi extended dengan atau tanpa portal vein embolization (PVE) preoperatif untuk menginduksi hipertrofi lobus hati kontralateral dapat dipertimbangkan. Tingkat morbiditas pasca operasi berkisar 30-50% dengan mortalitas 3-8% di pusat berpengalaman.
Kolangiokarsinoma perihilar (tumor Klatskin) memerlukan reseksi hepatobilier kompleks, umumnya hepatektomi kanan atau kiri extended dengan reseksi duktus biliaris, limfadenektomi regional, dan kadang reseksi parsial vena porta untuk mencapai margin negatif. Klasifikasi Bismuth-Corlette menentukan ekstensi reseksi berdasarkan keterlibatan konfluensi bilier. Operasi Whipple (pancreaticoduodenectomy) dilakukan untuk kolangiokarsinoma distal yang melibatkan duktus koledokus terminal dan kaput pankreas.
Studi terkini menunjukkan bahwa transplantasi hati dengan kemoradioterapi neoadjuvan (protokol Mayo Clinic) dapat memberikan survival jangka panjang pada pasien selektif dengan kolangiokarsinoma perihilar awal yang tidak resektabel secara konvensional, namun kandidat harus dipilih ketat dan protokol ini belum tersedia luas di Indonesia. Hasil survival 5 tahun mencapai 50-65% pada pusat dengan pengalaman protokol ini.
Kemoterapi
Untuk penyakit lanjut lokal atau metastatik yang tidak resektabel, kemoterapi sistemik menjadi pilar utama terapi. Studi landmark ABC-02 tahun 2010 menetapkan kombinasi gemcitabine plus cisplatin sebagai regimen standar lini pertama dengan median overall survival (OS) 11,7 bulan versus 8,1 bulan pada gemcitabine monoterapi. Rejimen ini tetap menjadi backbone terapi hingga kini dengan profil toksisitas yang dapat ditoleransi.
Penelitian TOPAZ-1 yang dipublikasikan tahun 2022 menunjukkan bahwa penambahan durvalumab (checkpoint inhibitor anti-PD-L1) pada kombinasi gemcitabine-cisplatin meningkatkan median OS menjadi 12,8 bulan dibanding 11,5 bulan pada kemoterapi saja, dengan hazard ratio 0,80 (95% CI 0,66-0,97). Inovasi ini menandai era baru imunoterapi pada kolangiokarsinoma, meskipun benefit absolut masih terbatas dan biaya terapi sangat tinggi. FDA menyetujui kombinasi ini sebagai lini pertama pada Agustus 2022.
Terapi lini kedua setelah progresi pada gemcitabine-cisplatin mencakup 5-fluorouracil (5-FU) dengan leucovorin dan oxaliplatin (FOLFOX), atau capecitabine kombinasi dengan oxaliplatin (CAPOX/XELOX). Studi ABC-06 tahun 2021 mendemonstrasikan bahwa FOLFOX meningkatkan median OS menjadi 6,2 bulan dibanding active symptom control (5,3 bulan) dengan hazard ratio 0,69, meskipun benefit absolut masih modest. Pemilihan rejimen lini kedua mempertimbangkan performance status pasien, toksisitas kumulatif, dan preferensi pasien.
Terapi Target Molekuler
Kemajuan signifikan terjadi dalam terapi target berbasis biomarker untuk kolangiokarsinoma. Mutasi IDH1 (isocitrate dehydrogenase 1) ditemukan pada 10-20% kolangiokarsinoma intrahepatik dan menjadi target ivosidenib, inhibitor IDH1 oral yang disetujui FDA tahun 2021 berdasarkan studi ClarIDHy. Pasien dengan mutasi IDH1 yang menerima ivosidenib menunjukkan median progression-free survival (PFS) 2,7 bulan versus 1,4 bulan pada plasebo, dengan median OS 10,3 bulan versus 7,5 bulan.
Fusi gen FGFR2 (fibroblast growth factor receptor 2) terjadi pada 10-16% kolangiokarsinoma intrahepatik dan targetable dengan inhibitor FGFR seperti pemigatinib, infigratinib, atau futibatinib. Studi FIGHT-202 menunjukkan pemigatinib mencapai objective response rate (ORR) 35,5% dengan median PFS 6,9 bulan pada pasien dengan fusi FGFR2 yang telah mendapat kemoterapi sebelumnya. FDA menyetujui pemigatinib tahun 2020 sebagai terapi lini kedua untuk pasien dengan fusi FGFR2.
Amplifikasi HER2/ERBB2 ditemukan pada 5-10% kasus dan dapat diobati dengan kombinasi trastuzumab dan pertuzumab seperti pada kanker payudara dan lambung HER2-positif, meskipun bukti pada kolangiokarsinoma masih terbatas pada studi kecil. Mutasi BRAF V600E (3-5% kasus) dapat ditarget dengan kombinasi dabrafenib dan trametinib sesuai hasil studi ROAR basket trial yang menunjukkan ORR 47% pada biliary tract cancer dengan mutasi BRAF V600E.
Profiling molekuler komprehensif menggunakan next-generation sequencing (NGS) menjadi semakin penting untuk mengidentifikasi alterasi genomik actionable dan memandu pemilihan terapi target. Panduan NCCN dan ESMO merekomendasikan testing molekuler untuk kolangiokarsinoma lanjut yang mencakup setidaknya IDH1, FGFR2, BRAF, HER2, dan mismatch repair deficiency (dMMR)/microsatellite instability-high (MSI-H).
Radioterapi
Peran radioterapi pada kolangiokarsinoma masih kontroversial dan terus berkembang. Radioterapi adjuvan pasca reseksi R1 (margin positif mikroskopis) dapat dipertimbangkan untuk meningkatkan kontrol lokoregional, meskipun bukti definitif dari randomized controlled trial masih terbatas. Dosis radioterapi eksternal konvensional berkisar 45-60 Gy dengan atau tanpa kemoterapi konkuren sebagai radiosensitizer.
Teknik radioterapi modern seperti intensity-modulated radiotherapy (IMRT) atau stereotactic body radiotherapy (SBRT) memungkinkan delivery dosis tinggi ke tumor dengan sparing jaringan sehat sekitar, terutama duodenum, usus halus, dan parenkim hati. SBRT menunjukkan hasil menjanjikan untuk kolangiokarsinoma intrahepatik lokal dengan kontrol lokal 1 tahun hingga 80-90% dan median OS 17-35 bulan pada studi retrospektif.
Brachytherapy intraluminal atau transkateter radioterapi interna selektif (SIRT) menggunakan Yttrium-90 microspheres sedang dieksplorasi untuk kolangiokarsinoma intrahepatik unresectable, dengan beberapa studi menunjukkan median OS 12-22 bulan pada pasien selektif. Namun, modalitas ini membutuhkan expertise tinggi dan belum tersedia di sebagian besar pusat kesehatan Indonesia.
Terapi Paliatif
Mayoritas pasien kolangiokarsinoma tidak kandidat terapi kuratif sehingga manajemen paliatif menjadi aspek penting perawatan. Drainase bilier untuk mengatasi ikterus obstruktif meningkatkan kualitas hidup dan memfasilitasi pemberian kemoterapi sistemik. Drainase dapat dilakukan melalui ERCP dengan stent plastik atau self-expanding metal stent (SEMS), atau percutaneous transhepatic biliary drainage (PTBD) jika ERCP tidak berhasil atau tidak feasible.
Pemilihan antara ERCP dan PTBD mempertimbangkan lokasi obstruksi, anatomi saluran empedu, expertise lokal, dan preferensi pasien. SEMS memiliki durabilitas lebih panjang dibanding stent plastik (patency 6-12 bulan versus 3-4 bulan) namun lebih mahal. Covered SEMS mengurangi ingrowth tumor namun meningkatkan risiko migrasi. Pada obstruksi kompleks bilateral perihilar, multiple stent atau drainase bilateral mungkin diperlukan.
Manajemen nyeri mengikuti WHO pain ladder dengan analgetik opioid sebagai backbone. Pruritus intraktabel akibat kolestasis dapat diobati dengan cholestyramine, rifampicin, naltrexone, atau sertraline. Malnutrisi dan malabsorpsi lemak sekunder akibat defisiensi garam empedu memerlukan suplementasi vitamin larut lemak (A, D, E, K) dan enzim pankreas. Dukungan nutrisi dengan diet tinggi kalori-protein dan suplementasi oral atau enteral meningkatkan toleransi terapi dan kualitas hidup.
Perawatan paliatif holistik mencakup manajemen gejala fisik, dukungan psikososial, spiritual, dan advance care planning. Rujukan awal ke tim paliatif menunjukkan benefit signifikan terhadap kualitas hidup dan bahkan survival pada berbagai keganasan stadium lanjut, termasuk kolangiokarsinoma.
Prognosis dan Survival
Prognosis kolangiokarsinoma secara keseluruhan tetap suram dengan median survival 6-12 bulan untuk penyakit lanjut tanpa terapi dan 11-15 bulan dengan kemoterapi standar. Tingkat survival 5 tahun untuk semua stadium berkisar 7-20%, mencerminkan agresivitas biologis tumor dan diagnosis yang sering terlambat. Faktor prognostik utama adalah resektabilitas tumor, status margin reseksi, stadium TNM, diferensiasi histologis, invasi vaskular, dan metastasis kelenjar getah bening.
Pasien yang menjalani reseksi R0 memiliki prognosis terbaik dengan median survival 24-48 bulan dan tingkat survival 5 tahun 20-40% tergantung stadium. Namun, tingkat rekurensi pasca reseksi kuratif sangat tinggi mencapai 60-70% dalam 2 tahun, dengan rekurensi intrahepatik lebih sering daripada metastasis jauh. Kemoterapi adjuvan dengan capecitabine berdasarkan studi BILCAP menunjukkan trend peningkatan median OS menjadi 53 bulan versus 36 bulan pada observasi, meskipun primary endpoint tidak tercapai dalam intention-to-treat analysis.
Kolangiokarsinoma intrahepatik cenderung memiliki prognosis lebih buruk dibanding ekstrahepatik karena diagnosis lebih terlambat dan tingkat resektabilitas lebih rendah. Tumor perihilar (Klatskin) memiliki tingkat survival 5 tahun pasca reseksi 20-30%, sedangkan tumor distal mencapai 30-40% karena lebih mudah direseksi komplit dengan margin adekuat.
Faktor molekuler emerging sebagai predictor prognosis dan respons terapi. Pasien dengan mutasi IDH1 atau fusi FGFR2 umumnya memiliki prognosis lebih baik dan responsif terhadap terapi target spesifik. Tumor dengan high tumor mutational burden (TMB) atau MSI-H menunjukkan sensitivitas terhadap imunoterapi checkpoint inhibitor. Ekspresi biomarker seperti PD-L1, infiltrasi limfosit tumor, dan rasio neutrofil-limfosit juga dikaitkan dengan outcome klinis.
Perkembangan terkini dalam liquid biopsy menggunakan ctDNA untuk monitoring dinamis beban tumor dan deteksi minimal residual disease pasca reseksi menjanjikan stratifikasi risiko lebih presisi dan deteksi rekurensi lebih dini. Namun, implementasi klinis rutin masih memerlukan validasi prospektif lebih lanjut.
Strategi Pencegahan dan Deteksi Dini
Pencegahan primer kolangiokarsinoma berfokus pada kontrol faktor risiko yang dapat dimodifikasi. Di area endemik infeksi Opisthorchis viverrini seperti Thailand dan Laos, kampanye edukasi kesehatan untuk menghindari konsumsi ikan mentah atau setengah matang, perbaikan sanitasi, dan program deworming massal menunjukkan penurunan prevalensi infeksi dan insidensi kolangiokarsinoma jangka panjang. Indonesia dengan prevalensi infeksi parasit hati lebih rendah memerlukan focus pada faktor risiko lain.
Vaksinasi hepatitis B universal dan screening hepatitis C dengan pengobatan antiviral dapat mengurangi risiko kolangiokarsinoma terkait hepatitis virus kronik. Manajemen optimal cholelithiasis simptomatik dengan kolesistektomi, drainase adekuat kista duktus koledokus dengan reseksi komplit, dan kontrol metabolik ketat pada diabetes dan obesitas merupakan strategi pencegahan sekunder yang relevan.
Surveillance rutin pada populasi risiko tinggi menjadi topik diskusi intens. Pasien dengan PSC direkomendasikan menjalani USG abdomen dan CA 19-9 setiap 6-12 bulan meskipun cost-effectiveness screening masih diperdebatkan. MRCP annual dapat memvisualisasikan perkembangan striktur baru atau massa. Pada pasien dengan anomali kongenital bilier, monitoring imaging berkala pasca koreksi bedah dipertimbangkan.
Deteksi dini melalui biomarker serum dan imaging masih menjadi tantangan besar karena karakteristik indolen kolangiokarsinoma stadium awal dan overlap CA 19-9 dengan kondisi benigna. Penelitian biomarker novel seperti methylated DNA, microRNA, exosome, atau panel protein serum sedang dieksplorasi untuk meningkatkan sensitivitas dan spesifisitas deteksi dini, namun belum ada yang siap untuk implementasi klinis luas.
Perspektif Regional Indonesia
Di Indonesia, tantangan utama manajemen kolangiokarsinoma mencakup diagnosis stadium lanjut akibat keterbatasan akses layanan kesehatan, keterlambatan rujukan, dan rendahnya awareness masyarakat terhadap gejala awal. Mayoritas pasien datang dengan ikterus obstruktif yang sudah tidak resektabel, membatasi opsi terapi kuratif. Infrastruktur diagnostik seperti MRCP dan EUS belum tersedia merata di seluruh Indonesia, terkonsentrasi di rumah sakit rujukan nasional dan regional.
Akses terapi target dan imunoterapi sangat terbatas karena biaya tinggi yang mencapai ratusan juta rupiah per bulan dan belum tercakup dalam skema Jaminan Kesehatan Nasional (JKN). Profiling molekuler NGS juga belum menjadi standar praktik karena keterbatasan fasilitas dan biaya. Kemoterapi standar gemcitabine-cisplatin tersedia di pusat onkologi mayor namun akses di daerah perifer masih terbatas.
Kapasitas bedah hepatobilier untuk reseksi kompleks kolangiokarsinoma perihilar hanya tersedia di beberapa pusat nasional dengan expertise tinggi seperti RSUPN Dr. Cipto Mangunkusumo Jakarta, RSUP Dr. Sardjito Yogyakarta, dan RSUP Dr. Soetomo Surabaya. Mortalitas dan morbiditas perioperatif di Indonesia kemungkinan lebih tinggi dibanding pusat internasional karena kurva pembelajaran dan volume kasus.
Data epidemiologi nasional spesifik kolangiokarsinoma masih terfragmentasi dalam registrasi kanker berbasis rumah sakit. Globocan 2020 memperkirakan beban kolangiokarsinoma di Indonesia namun dengan uncertainties tinggi. Penelitian multicenter nasional diperlukan untuk memahami karakteristik penyakit, faktor risiko lokal, dan outcome terapi dalam konteks Indonesia untuk mengoptimalkan guideline manajemen sesuai resource setting.
Edukasi tenaga kesehatan primer dan sekunder tentang gejala dan tanda kolangiokarsinoma dapat meningkatkan deteksi dini dan rujukan tepat waktu. Program pelatihan USG point-of-care untuk identifikasi dilatasi bilier dan massa hepar di fasilitas primer dapat mempercepat diagnosis. Telemedicine consultation dengan spesialis hepatobilier untuk interpretasi imaging dan perencanaan manajemen dapat memfasilitasi akses expertise di daerah terpencil.
Kesimpulan
Kolangiokarsinoma tetap menjadi tantangan onkologi kompleks dengan prognosis yang umumnya buruk namun terus menunjukkan perkembangan signifikan dalam pemahaman patogenesis molekuler, teknik diagnostik, dan modalitas terapi terutama terapi target dan imunoterapi. Deteksi dini melalui surveillance populasi risiko tinggi, reseksi bedah dengan margin adekuat pada penyakit lokal resektabel, dan kemoterapi sistemik dikombinasikan dengan terapi target berbasis biomarker pada penyakit lanjut merupakan pendekatan terkini yang evidence-based.
Implementasi profiling molekuler komprehensif untuk identifikasi alterasi genomik actionable harus menjadi standar perawatan kolangiokarsinoma lanjut guna memaksimalkan benefit terapi target. Penelitian berkelanjutan dalam liquid biopsy, biomarker novel, dan kombinasi terapi sistemik-lokoregional menjanjikan peningkatan outcome di masa depan. Pendekatan multidisiplin melibatkan gastroenterologis, hepatologis, bedah hepatobilier, onkologis, radiologis, ahli patologi, dan paliatif care esensial untuk optimalisasi manajemen holistik.
Dalam konteks Indonesia, peningkatan kapasitas diagnostik dan terapeutik, edukasi tenaga kesehatan dan masyarakat, serta penelitian epidemiologi dan outcome lokal diperlukan untuk memperbaiki burden penyakit ini. Kolaborasi regional dalam clinical trial dan registry dapat mempercepat akses terapi inovatif dan generate evidence berkualitas tinggi untuk populasi Asia. Dengan kemajuan sains dan kedokteran yang pesat, terdapat optimisme bahwa outcome kolangiokarsinoma akan terus membaik, mengubah penyakit yang dahulu hampir universally fatal menjadi kondisi yang dapat dimanage dengan survival bermakna.
Referensi
Banales, J. M., Marin, J. J. G., Lamarca, A., Rodrigues, P. M., Khan, S. A., Roberts, L. R., Cardinale, V., Carpino, G., Andersen, J. B., Braconi, C., Calvisi, D. F., Perugorría, M. J., Fabris, L., Boulter, L., Macias, R. I. R., Gaudio, E., Alvaro, D., Gradilone, S. A., Strazzabosco, M., … Valle, J. W. (2020). Cholangiocarcinoma 2020: The next horizon in mechanisms and management. Nature Reviews Gastroenterology & Hepatology, 17(9), 557–588. https://doi.org/10.1038/s41575-020-0310-z
Kelley, R. K., Bridgewater, J., Gores, G. J., & Zhu, A. X. (2020). Systemic therapies for intrahepatic cholangiocarcinoma. Journal of Hepatology, 72(2), 353–363. https://doi.org/10.1016/j.jhep.2019.10.009
Oh, D. Y., Ruth He, A., Qin, S., Chen, L. T., Okusaka, T., Vogel, A., Kim, J. W., Suksombooncharoen, T., Ah Lee, M., Kitano, M., Burris, H. A., Bouattour, M., Tanasanvimon, S., Zaucha, R., Avallone, A., Tsuji, K., Ryoo, B. Y., Chongpison, Y., Raymond, E., … Oh, D. Y. (2022). Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer. NEJM Evidence, 1(8), EVIDoa2200015. https://doi.org/10.1056/EVIDoa2200015
Primrose, J. N., Fox, R. P., Palmer, D. H., Malik, H. Z., Prasad, R., Mirza, D., Anthony, A., Corrie, P., Falk, S., Finch-Jones, M., Wasan, H., Ross, P., Wall, L., Wadsley, J., Evans, J. T. R., Stocken, D., Praseedom, R., Ma, Y. T., Davidson, B., … Valle, J. W. (2019). Capecitabine compared with observation in resected biliary tract cancer (BILCAP): A randomised, controlled, multicentre, phase 3 study. The Lancet Oncology, 20(5), 663–673. https://doi.org/10.1016/S1470-2045(18)30915-X
Abou-Alfa, G. K., Macarulla, T., Javle, M. M., Kelley, R. K., Lubner, S. J., Adeva, J., Cleary, J. M., Catenacci, D. V., Borad, M. J., Bridgewater, J., Harris, W. P., Murphy, A. G., Oh, D. Y., Whisenant, J., Lowery, M. A., Goyal, L., Shroff, R. T., El-Khoueiry, A. B., Fan, B., … Zhu, A. X. (2020). Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): A multicentre, randomised, double-blind, placebo-controlled, phase 3 study. The Lancet Oncology, 21(6), 796–807. https://doi.org/10.1016/S1470-2045(20)30157-1
Abou-Alfa, G. K., Sahai, V., Hollebecque, A., Vaccaro, G., Melisi, D., Al-Rajabi, R., Paulson, A. S., Borad, M. J., Gallinson, D., Murphy, A. G., Oh, D. Y., Dotan, E., Catenacci, D. V., Van Cutsem, E., Ji, T., Lihou, C. F., Zhen, H., Féliz, L., & Vogel, A. (2020). Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: A multicentre, open-label, phase 2 study. The Lancet Oncology, 21(5), 671–684. https://doi.org/10.1016/S1470-2045(20)30109-1
Lamarca, A., Palmer, D. H., Wasan, H. S., Ross, P. J., Ma, Y. T., Arora, A., Falk, S., Gillmore, R., Wadsley, J., Patel, K., Anthoney, A., Maraveyas, A., Iveson, T., Waters, J. S., Hobbs, C., Barber, S., Rogan, J., Rees, C., Gilligan, D., … Valle, J. W. (2021). Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): A phase 3, open-label, randomised, controlled trial. The Lancet Oncology, 22(5), 690–701. https://doi.org/10.1016/S1470-2045(21)00027-9
Rizvi, S., Khan, S. A., Hallemeier, C. L., Kelley, R. K., & Gores, G. J. (2018). Cholangiocarcinoma—Evolving concepts and therapeutic strategies. Nature Reviews Clinical Oncology, 15(2), 95–111. https://doi.org/10.1038/nrclinonc.2017.157
Valle, J. W., Borbath, I., Khan, S. A., Huguet, F., Gruenberger, T., & Arnold, D. (2016). Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 27(suppl_5), v28–v37. https://doi.org/10.1093/annonc/mdw324
Vogel, A., Bridgewater, J., Edeline, J., Kelley, R. K., Klümpen, H. J., Malka, D., Primrose, J. N., Rimassa, L., Stenzinger, A., Valle, J. W., & Ducreux, M. (2023). Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 34(2), 127–140. https://doi.org/10.1016/j.annonc.2022.10.506
Shroff, R. T., Kennedy, E. B., Bachini, M., Bekaii-Saab, T., Crane, C., Edeline, J., El-Khoueiry, A., Feng, M., Katz, M. H. G., Primrose, J., Sohal, D. P. S., Valle, J., Maithel, S., & Borad, M. J. (2019). Adjuvant therapy for resected biliary tract cancer: ASCO Clinical Practice Guideline. Journal of Clinical Oncology, 37(12), 1015–1027. https://doi.org/10.1200/JCO.18.02178

Tinggalkan komentar