- Epidemiologi: Beban Penyakit Global dan Situasi di Indonesia
- Patofisiologi: Siklus Hidup Parasit dan Mekanisme Penyakit
- Manifestasi Klinis: Dari Infeksi Akut hingga Komplikasi Kronis
- Diagnosis: Metode Deteksi dan Tantangannya
- Pengobatan: Prazikuantel sebagai Terapi Lini Pertama
- Pencegahan dan Pengendalian: Pendekatan Multisektoral
- Kesimpulan
- Daftar Referensi
Schistosomiasis, atau lebih dikenal dengan sebutan bilharzia, merupakan penyakit infeksi parasit yang telah menginfeksi manusia selama ribuan tahun. Penyakit yang disebabkan oleh cacing pipih dari genus Schistosoma ini menjadi salah satu penyakit tropis terabaikan (neglected tropical diseases) yang paling berdampak terhadap kesehatan masyarakat global, khususnya di wilayah beriklim tropis dan subtropis. Organisasi Kesehatan Dunia (WHO) memperkirakan sekitar 236,6 juta orang memerlukan pengobatan pencegahan pada tahun 2019, dengan sekitar 779 juta orang berisiko tertular infeksi ini.
Epidemiologi: Beban Penyakit Global dan Situasi di Indonesia
Schistosomiasis dilaporkan dari 78 negara di dunia, dengan konsentrasi kasus tertinggi berada di Afrika Sub-Sahara. Penyakit ini juga ditemukan di Asia, Karibia, dan Amerika Selatan. Menurut pedoman WHO tahun 2022, schistosomiasis tetap menjadi masalah kesehatan masyarakat yang signifikan meskipun upaya pengendalian telah dilakukan selama beberapa dekade. Program kemoterapi pencegahan telah berhasil mengurangi morbiditas terkait schistosomiasis, namun prevalensi global tetap tinggi, terutama di daerah endemik dengan akses terbatas terhadap air bersih dan sanitasi yang memadai.
Di Indonesia, schistosomiasis japonica hanya ditemukan di tiga daerah terpencil di Provinsi Sulawesi Tengah, yaitu Dataran Tinggi Lindu dan Napu (Kabupaten Sigi dan Poso), serta Dataran Tinggi Bada (Kabupaten Poso). Penyakit ini pertama kali ditemukan di Indonesia pada tahun 1937 di desa Tomado, dengan prevalensi awal yang sangat tinggi mencapai 56-72% di beberapa desa pada tahun 1940-an. Berkat program pengendalian terpadu yang dimulai sejak 1982, prevalensi berhasil diturunkan menjadi kurang dari 1% pada tahun 2005. Namun, data kontemporer menunjukkan tren peningkatan prevalensi antara tahun 2008-2011, dengan prevalensi berkisar 0,8-4,8% di daerah endemik.
Indonesia menjadi negara terakhir di Kawasan Asia Tenggara yang masih berupaya mengeliminasi schistosomiasis sebagai masalah kesehatan masyarakat. Pada tahun 2022, data menunjukkan 11 kasus dilaporkan di Lindu dan 205 kasus di Napu, sementara 12 dari 28 desa endemik telah melaporkan nol kasus selama tiga tahun berturut-turut sejak 2019. WHO memproyeksikan Indonesia akan menjadi negara kedua di dunia setelah Jepang yang berhasil mengeliminasi schistosomiasis.
Patofisiologi: Siklus Hidup Parasit dan Mekanisme Penyakit
Schistosomiasis disebabkan oleh cacing pipih dioecious (terpisah jenis kelamin) dari genus Schistosoma. Terdapat beberapa spesies utama yang menginfeksi manusia: S. haematobium (schistosomiasis urogenital), S. mansoni dan S. japonicum (schistosomiasis intestinal), serta S. mekongi dan S. intercalatum. Di Indonesia, spesies yang ditemukan adalah S. japonicum dengan keong perantara Oncomelania hupensis lindoensis.
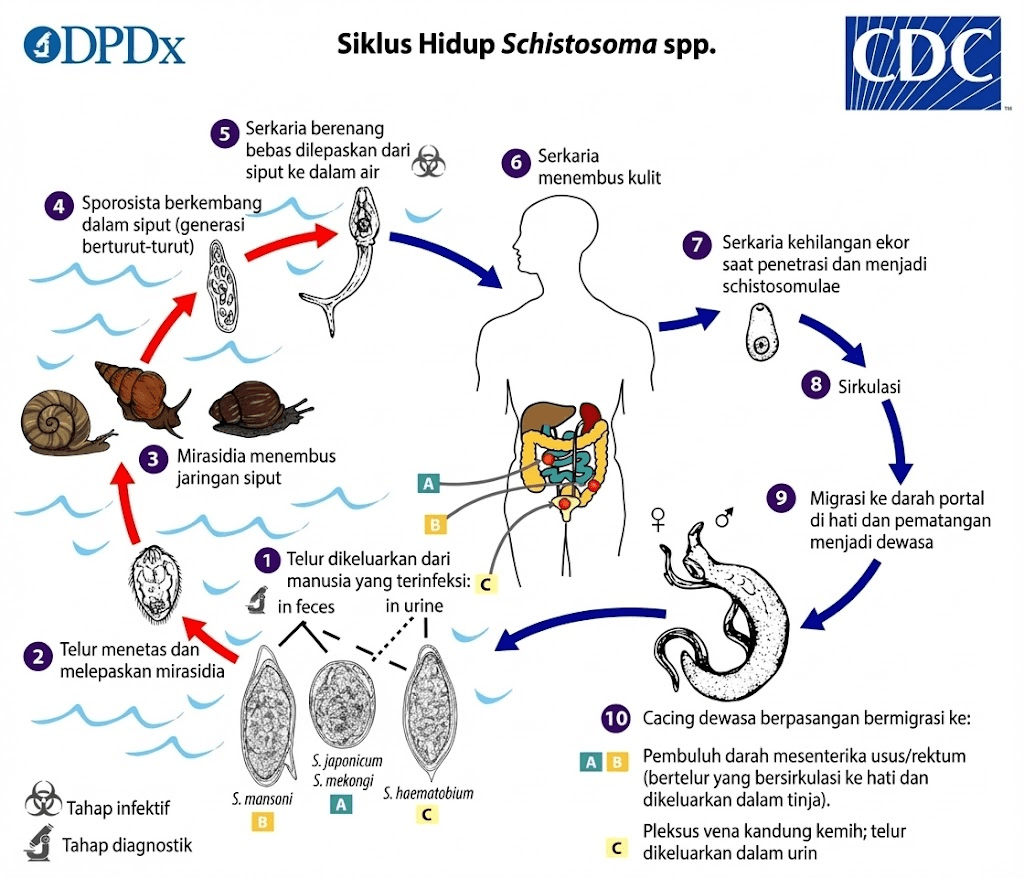
Siklus hidup parasit ini kompleks dan melibatkan inang perantara keong air tawar serta inang definitif mamalia, termasuk manusia. Infeksi dimulai ketika telur parasit yang dikeluarkan melalui feses atau urin manusia yang terinfeksi mencemari sumber air tawar. Telur menetas di air dan melepaskan larva bersilia yang disebut mirasidium, yang kemudian menginfeksi keong air tawar yang spesifik. Di dalam tubuh keong, mirasidium berkembang biak secara aseksual dan menghasilkan ribuan serkaria (larva bercabang ekor) yang dilepaskan ke dalam air.
Manusia terinfeksi ketika serkaria menembus kulit selama kontak dengan air yang terkontaminasi. Setelah penetrasi kulit, serkaria kehilangan ekornya dan berubah menjadi skistosomulum yang kemudian bermigrasi melalui sistem peredaran darah menuju paru-paru, kemudian ke hati. Di dalam vena portal hati, skistosomulum berkembang menjadi cacing dewasa yang kemudian berpasangan dan bermigrasi ke lokasi akhir mereka: vena mesenterika untuk S. mansoni dan S. japonicum, atau pleksus vena kandung kemih untuk S. haematobium.
Cacing betina dewasa mulai memproduksi telur setelah 4-6 minggu pasca-infeksi. Sebagian telur berhasil melewati dinding pembuluh darah dan jaringan untuk dikeluarkan melalui feses atau urin, melanjutkan siklus hidup parasit. Namun, sebagian besar telur terperangkap dalam jaringan tubuh, terutama di hati, usus, kandung kemih, atau organ lainnya. Telur yang terperangkap ini memicu respons imun granulomatosa yang menjadi penyebab utama patologi dan morbiditas schistosomiasis.
Penelitian terbaru menunjukkan bahwa infeksi S. mansoni dengan intensitas tinggi dikaitkan dengan komposisi mikrobiota usus yang berbeda dan kadar sitokin sistemik yang rendah pada anak-anak. Studi di Uganda menemukan bahwa genus Phascolarctobacterium dan Prevotella_7 secara signifikan diperkaya pada kelompok dengan intensitas infeksi tinggi, sementara Ruminobacter dan Alloprevotella diperkaya pada kelompok intensitas rendah. Beberapa genus bakteri usus ini juga menunjukkan asosiasi dengan respons sitokin IL-6 sistemik, menunjukkan hubungan kompleks antara mikrobiota, parasit, dan respons imun host.
Manifestasi Klinis: Dari Infeksi Akut hingga Komplikasi Kronis
Manifestasi klinis schistosomiasis sangat bervariasi tergantung pada spesies parasit, intensitas infeksi, durasi infeksi, dan respons imun individu. Perjalanan penyakit dapat dibagi menjadi beberapa fase: fase akut (demam Katayama), fase kronis, dan komplikasi organ.
Fase Akut (Demam Katayama)
Fase akut terjadi 2-8 minggu setelah infeksi primer yang masif, terutama pada individu yang belum memiliki kekebalan sebelumnya. Gejala menyerupai penyakit serum sickness dengan demam tinggi, menggigil, batuk, nyeri otot, nyeri perut, diare, dan ruam urtikaria. Pada pemeriksaan laboratorium dapat ditemukan eosinofilia (peningkatan eosinofil) yang mencolok. Fase ini sebenarnya jarang terjadi pada penduduk daerah endemik yang telah mengalami paparan berulang sejak usia dini.
Fase Kronis
Fase kronis berkembang bertahap akibat deposisi telur yang terus-menerus di jaringan dan respons granulomatosa yang ditimbulkannya. Manifestasi klinis bervariasi berdasarkan spesies:
- Schistosomiasis Intestinal (S. mansoni, S. japonicum, S. mekongi, S. intercalatum): Gejala gastrointestinal meliputi nyeri perut, diare berdarah, dan malabsorpsi. Deposisi telur di hati menyebabkan fibrosis periportal (fibrosis Symmers) yang dapat berkembang menjadi hipertensi portal dengan splenomegali, varises esofagus, dan asites. Studi di Tanzania menunjukkan bahwa schistosomiasis merupakan penyebab utama hipertensi portal di Afrika Sub-Sahara, dengan 53,9% kasus hipertensi portal disebabkan oleh schistosomiasis, diikuti oleh infeksi virus hepatitis (26,6%).
- Schistosomiasis Urogenital (S. haematobium): Hematuria (darah dalam urin) merupakan gejala patognomonik. Komplikasi kronis meliputi fibrosis kandung kemih, hidronefrosis, gagal ginjal kronis, dan peningkatan risiko karsinoma sel skuamosa kandung kemih. Pada wanita, deposisi telur di traktus genitalia dapat menyebabkan schistosomiasis genital yang dikaitkan dengan peningkatan risiko infeksi HIV. Sebuah laporan kasus di Ethiopia tahun 2025 menggambarkan bagaimana schistosomiasis serviks dapat menyerupai karsinoma invasif, menunjukkan pentingnya mempertimbangkan schistosomiasis dalam diagnosis diferensial lesi serviks, terutama di daerah endemik.
Komplikasi Organ Spesifik
Selain manifestasi klasik, schistosomiasis dapat menyebabkan komplikasi pada berbagai organ:
- Komplikasi Ginjal: Penelitian terbaru menyoroti schistosomiasis sebagai penyebab penyakit glomerular yang kurang dikenali di daerah tropis. Infeksi dapat memicu cedera glomerular yang dimediasi imun, berkontribusi pada cedera ginjal akut, atau menyebabkan penyakit ginjal kronis. Lesi glomerular spesifik meliputi glomerulonefritis mesangioproliferatif, glomerulonefritis membranoproliferatif, dan glomerulosklerosis fokal segmental.
- Komplikasi Paru dan Jantung: Telur parasit yang tersangkut di pembuluh darah paru dapat menyebabkan hipertensi arteri pulmonal (PAH), komplikasi serius yang diperkirakan mempengaruhi hingga 15% pasien dengan bentuk hepatosplenik penyakit. Studi di Brasil menunjukkan bahwa PAH terkait schistosomiasis tetap menjadi penyebab yang terabaikan, dengan patofisiologi yang melibatkan vaskulopati proliferatif. Diagnosis standar emas adalah kateterisasi jantung kanan, namun akses terhadap prosedur ini sangat terbatas di daerah endemik.
- Neuroschistosomiasis: Deposisi telur di sistem saraf pusat dapat menyebabkan mielitis transversa, kejang, atau gejala neurologis fokal. Sebuah laporan kasus di Malawi tahun 2025 menggambarkan seorang remaja hamil yang mengalami paralisis reversibel akibat infeksi ganda malaria dan schistosomiasis. Pasien mengalami kelemahan progresif ekstremitas bawah dan kandung kemih neurogenik, yang membaik setelah pengobatan prednison dan prazikuantel.
Diagnosis: Metode Deteksi dan Tantangannya
Diagnosis definitif schistosomiasis memerlukan deteksi telur parasit dalam feses (untuk schistosomiasis intestinal) atau urin (untuk schistosomiasis urogenital). Namun, metode mikroskopis konvensional memiliki keterbatasan signifikan dalam mendeteksi infeksi intensitas rendah.
Metode Mikroskopis Konvensional
- Metode Kato-Katz: Metode standar untuk deteksi telur S. mansoni dan S. japonicum dalam feses. Teknik ini melibatkan pemeriksaan apusan tebal feses di bawah mikroskop. Meskipun sederhana dan murah, sensitivitasnya rendah pada infeksi intensitas rendah dan memerlukan multiple sampel untuk meningkatkan akurasi.
- Filtrasi Urin: Digunakan untuk deteksi telur S. haematobium dalam urin. Sampel urin yang dikumpulkan antara pukul 10.00-14.00 (saat ekskresi telur maksimal) difiltrasi dan membran filter diperiksa di bawah mikroskop.
Metode Deteksi Antigen
Penelitian terkini menekankan pentingnya menggunakan metode diagnostik yang lebih sensitif untuk mendeteksi infeksi aktif dan memantau efikasi pengobatan. Studi di Brasil tahun 2025 mengevaluasi efikasi berbagai rejimen prazikuantel menggunakan metode Kato-Katz dan deteksi Circulating Anodic Antigen (CAA) dengan teknik Up-Converting Particle Lateral Flow (UCP-LF). Penelitian ini menemukan bahwa tingkat kesembuhan sangat bervariasi tergantung metode diagnostik yang digunakan: metode Kato-Katz menunjukkan tingkat kesembuhan 100% pada semua kelompok, sementara UCP-LF CAA mengungkapkan bahwa tidak semua pasien benar-benar sembuh, dengan tingkat kesembuhan berkisar 43,8-69,6%. Temuan ini menyoroti bahwa tingkat kesembuhan dapat terlalu tinggi diestimasi ketika hanya berdasarkan kuantifikasi telur, dan pentingnya menggunakan alat yang lebih sensitif untuk deteksi infeksi aktif.
Metode Molekuler dan Biomarker Baru
Teknologi molekuler seperti Polymerase Chain Reaction (PCR) menawarkan sensitivitas dan spesifisitas yang lebih tinggi. Studi di Mesir tahun 2025 menyelidiki peran mikroRNA yang berasal dari host (mmu-miR-214-3p) dan parasit (sma-bantam-5p) sebagai biomarker untuk diagnosis S. mansoni. Penelitian menemukan bahwa miR-214-3p serum meningkat secara signifikan sejak minggu keempat pasca-infeksi, bahkan pada infeksi intensitas rendah, sementara sma-bantam-5p terdeteksi mulai minggu kedelapan pasca-infeksi. Yang menarik, kadar ekspresi kedua mikroRNA berkurang secara signifikan setelah pengobatan prazikuantel, menunjukkan potensinya sebagai biomarker untuk mendeteksi kasus dini, menilai intensitas infeksi, memantau patologi penyakit, dan respons terhadap pengobatan.
Pemeriksaan Penunjang Lainnya
Ultrasonografi merupakan alat penting untuk menilai kerusakan organ, terutama fibrosis hati dan hidronefrosis. Pedoman WHO merekomendasikan ultrasonografi untuk menilai morbiditas terkait schistosomiasis, terutama untuk memantau perkembangan penyakit pada pasien kronis. Pemeriksaan darah lengkap sering menunjukkan eosinofilia, terutama pada fase akut atau infeksi baru.
Pengobatan: Prazikuantel sebagai Terapi Lini Pertama
Prazikuantel tetap menjadi obat pilihan utama untuk semua bentuk schistosomiasis sejak diperkenalkan pada tahun 1970-an. Obat ini efektif terhadap semua spesies Schistosoma yang menginfeksi manusia, relatif aman, dan tersedia dengan harga terjangkau.
Dosis dan Rejimen Pengobatan
Menurut pedoman WHO tahun 2022, dosis standar prazikuantel adalah:
- 40 mg/kg berat badan dosis tunggal untuk S. haematobium, S. mansoni, S. intercalatum
- 60 mg/kg berat badan dosis tunggal (dapat dibagi dalam dua dosis terpisah) untuk S. japonicum dan S. mekongi
Pedoman terbaru memperluas cakupan pengobatan dari yang sebelumnya berfokus pada anak usia sekolah menjadi semua kelompok usia dari 2 tahun ke atas, termasuk wanita hamil (setelah trimester pertama) dan wanita menyusui. Keputusan untuk memberikan pengobatan pada anak di bawah 2 tahun harus didasarkan pada pemeriksaan dan penilaian klinis.
Efikasi dan Evaluasi Pengobatan
Penelitian di Brasil tahun 2025 mengevaluasi efikasi berbagai rejimen pengobatan prazikuantel: dosis standar tunggal, dua dosis dengan jarak 24 jam, dan dua dosis dengan jarak 30 hari. Hasil menunjukkan bahwa Intensity Reduction Rate (IRR) mencapai 100% (berdasarkan Kato-Katz) dan >97% (berdasarkan UCP-LF CAA) pada semua kelompok, melampaui ambang batas efikasi WHO (>90%). Namun, deteksi CAA mengungkapkan bahwa beberapa pasien masih memiliki infeksi residual meskipun tidak ada telur yang terdeteksi dalam feses, menunjukkan pentingnya pemantauan jangka panjang.
Pengobatan Komplikasi
Untuk komplikasi serius seperti neuroschistosomiasis, rejimen pengobatan sering mencakup kortikosteroid (prednison atau deksametason) yang diberikan sebelum prazikuantel untuk mengurangi respons inflamasi terhadap telur yang mati. Laporan kasus dari Malawi menunjukkan bahwa pemberian prednison sebelum prazikuantel pada neuroschistosomiasis menghasilkan perbaikan neurologis yang signifikan.
Untuk hipertensi arteri pulmonal terkait schistosomiasis, pengobatan mirip dengan PAH dari penyebab lain, termasuk vasodilator pulmonal, tetapi dampak terapi antihelmin terhadap evolusi patologi vaskular masih belum jelas dan memerlukan penelitian lebih lanjut.
Resistensi dan Alternatif Pengobatan
Meskipun resistensi prazikuantel masih jarang, kekhawatiran tentang resistensi potensial meningkat seiring dengan penggunaan massal obat ini. Penelitian terbaru tentang hibridisasi antara S. haematobium dan S. bovis (parasit ternak) di Afrika menunjukkan bahwa bentuk hibrida ini dapat berpotensi lebih resisten terhadap prazikuantel, meskipun data empiris masih terbatas. Hal ini menekankan pentingnya pengembangan obat alternatif dan strategi pengendalian terintegrasi yang tidak hanya bergantung pada kemoterapi.
Pencegahan dan Pengendalian: Pendekatan Multisektoral
WHO telah menetapkan target eliminasi schistosomiasis sebagai masalah kesehatan masyarakat (didefinisikan sebagai prevalensi infeksi intensitas berat <1%) pada 100% negara endemik pada tahun 2030, dengan interrupsi transmisi pada negara-negara tertentu. Pencapaian target ini memerlukan pendekatan komprehensif yang melibatkan berbagai strategi.
Kemoterapi Pencegahan Massal
Pedoman WHO tahun 2022 merekomendasikan kemoterapi pencegahan tahunan dengan prazikuantel dosis tunggal pada cakupan pengobatan ≥75% untuk semua kelompok usia mulai dari 2 tahun di komunitas endemik dengan prevalensi infeksi Schistosoma spp. ≥10%. Strategi ini bertujuan mengendalikan morbiditas schistosomiasis dan memajukan eliminasi penyakit sebagai masalah kesehatan masyarakat.
Prevalensi diukur sebagai persentase individu dari semua usia dalam populasi sasaran yang terinfeksi spesies Schistosoma mana pun berdasarkan mikroskopi parasitologi menggunakan apusan Kato-Katz duplikat dari satu sampel feses untuk schistosomiasis intestinal atau filtrasi urin untuk schistosomiasis urogenital. Pendekatan ini merupakan perubahan signifikan dari strategi sebelumnya yang berfokus pada anak usia sekolah.
Akses terhadap Air Bersih dan Sanitasi (WASH)
Koordinasi dan perencanaan bersama antara program pengendalian schistosomiasis dan program WASH sangat penting. Pemetaan dan berbagi informasi epidemiologi bersama dengan cakupan WASH diperlukan untuk memastikan prioritas layanan air dan sanitasi ke daerah endemik schistosomiasis. Program pendidikan kesehatan dan penyampaian program schistosomiasis harus mencakup masukan untuk desain program WASH, kolaborasi pada intervensi perubahan perilaku, dan integrasi promosi perubahan perilaku.
Pengendalian Keong Perantara
Di tempat-tempat di mana fokus transmisi persisten muncul selama kampanye kemoterapi pencegahan, pengendalian populasi keong inang perantara harus diprioritaskan, terutama jika program sudah mencapai tingkat cakupan pengobatan yang tinggi. Ko-implementasi pengendalian keong dengan kampanye pengobatan massal diharapkan dapat mempercepat pencapaian tujuan WHO untuk pengendalian morbiditas dan eliminasi sebagai masalah kesehatan masyarakat.
Di Indonesia, survei malakologi menunjukkan penurunan jumlah habitat, kepadatan keong, dan tingkat infeksi keong antara survei tahun 2017 dan 2021 di Kabupaten Sigi dan Poso. Kegiatan pengendalian keong yang dilakukan meliputi intervensi berbasis air, konversi area fokus menjadi lahan produktif, sistem irigasi, dan penggunaan moluskisida. Pendekatan terintegrasi ini menunjukkan hasil yang menjanjikan dalam mengurangi transmisi.
Pengelolaan Reservoir Hewan
Schistosomiasis zoonotik, terutama S. japonicum, memiliki reservoir hewan yang luas termasuk sapi, kerbau, domba, kambing, dan hewan pengerat. Di Indonesia, prevalensi infeksi pada tikus berkisar antara 6,7-18,2% di daerah endemik. Transmisi yang dipertahankan oleh reservoir hewan ini menjadi tantangan signifikan dalam upaya eliminasi. Strategi pengendalian harus mencakup pendekatan One Health yang melibatkan sektor kesehatan hewan, pertanian, dan lingkungan.
Hibridisasi antara Schistosoma manusia dan ternak di Afrika menambah kompleksitas pengendalian. Studi terbaru menunjukkan bahwa S. haematobium (manusia) dan S. bovis (ternak) memiliki inang keong yang sama dan dapat menghasilkan hibridisasi selama fase seksual perkembangan parasit pada inang mamalia. Pertukaran genetik ini menghasilkan pembentukan hibrida schistosom yang dapat menimbulkan masalah untuk diagnosis, pengobatan, dan program pengendalian.
Tantangan Implementasi di Indonesia
Eliminasi schistosomiasis di Indonesia menghadapi beberapa tantangan signifikan:
- Keterbatasan Komitmen Multisektoral: Kurangnya komitmen dari kementerian non-kesehatan dan kantor pemerintah daerah menghambat implementasi strategi terintegrasi.
- Aktivitas Berbasis Komunitas yang Terbatas: Partisipasi masyarakat dalam kegiatan pengendalian masih perlu ditingkatkan.
- Metode Surveilans dan Diagnostik yang Tidak Memadai: Keterbatasan akses terhadap metode diagnostik sensitif mempersulit deteksi kasus intensitas rendah dan pemantauan efektivitas program.
- Akses Terbatas terhadap Pengobatan Hewan: Kurangnya ketersediaan obat untuk pengobatan hewan reservoir menjadi hambatan dalam pendekatan One Health.
- Sumber Daya Keuangan Terbatas: Keterbatasan dana menghambat implementasi dan keberlanjutan program.
Meskipun demikian, Indonesia menunjukkan kemajuan signifikan. Gubernur Sulawesi Tengah menekankan bahwa eliminasi schistosomiasis memerlukan upaya kolaboratif lintas sektor, termasuk kesehatan hewan, pertanian, infrastruktur, dan perubahan perilaku manusia. WHO memproyeksikan bahwa keberhasilan eliminasi di Indonesia akan berkontribusi signifikan terhadap pencapaian Tujuan Pembangunan Berkelanjutan 3, yang berfokus pada memastikan kehidupan sehat dan meningkatkan kesejahteraan untuk semua.
Kesimpulan
Schistosomiasis tetap menjadi masalah kesehatan masyarakat yang signifikan meskipun upaya pengendalian telah dilakukan selama beberapa dekade. Penyakit ini tidak hanya menyebabkan morbiditas akut dan kronis yang substansial, tetapi juga berkontribusi pada kemiskinan dan ketidaksetaraan kesehatan global. Pendekatan multisektoral yang komprehensif, mencakup kemoterapi pencegahan massal, peningkatan akses terhadap air bersih dan sanitasi, pengendalian keong perantara, dan manajemen reservoir hewan, sangat penting untuk mencapai target eliminasi WHO tahun 2030.
Kemajuan teknologi diagnostik, termasuk deteksi antigen dan biomarker molekuler, menawarkan harapan untuk deteksi dini yang lebih baik dan pemantauan efektivitas pengobatan yang lebih akurat. Di Indonesia, upaya eliminasi schistosomiasis di Sulawesi Tengah merupakan langkah penting yang tidak hanya akan menguntungkan kesehatan masyarakat setempat, tetapi juga berkontribusi pada eliminasi global penyakit tropis terabaikan ini.
Keberhasilan program eliminasi memerlukan komitmen berkelanjutan dari pemerintah, masyarakat internasional, dan komunitas lokal, serta integrasi yang efektif antara berbagai sektor kesehatan, lingkungan, dan pembangunan sosial-ekonomi.
Daftar Referensi
Addis, N. A., Yigzaw, K. T., Ahmed, O. A., Yemru, G. M., Wagaw, A. C., Worku, M. A., & Yefter, E. T. (2025). Cervical schistosomiasis masquerading as invasive carcinoma: A case report. BMC Infectious Diseases, 25(1), 1654. https://doi.org/10.1186/s12879-025-12099-4
Bobrovski, V. G., Pinheiro, A. L., de-Castro, J. A. L., Rech, E. B., Zacarkim, E. V., Dos-S-Reis, E. S., & Eger, I. (2023). Schistosomiasis: A neglected cause of pulmonary arterial hypertension in Brazil. Current Problems in Cardiology, 49(3), 102340. https://doi.org/10.1016/j.cpcardiol.2023.102340
Brito, M. I. B. D. S., Oliveira, E. C. A. D., Barbosa, C. S., & Gomes, E. C. D. S. (2023). Factors associated with severe forms and deaths from schistosomiasis and application of probabilistic linkage in databases, state of Pernambuco, Brazil, 2007-2017. Revista Brasileira de Epidemiologia, 26, e230003. https://doi.org/10.1590/1980-549720230003.2
Chancharoenthana, W., Leelahavanichkul, A., Ronco, C., & Schultz, M. J. (2025). Tropical kidney diseases: Underrepresented in foundational English-language medical education resources. Renal Failure, 47(1), 2564375. https://doi.org/10.1080/0886022X.2025.2564375
de Freitas Galvão, R. L., Hoekstra, P. T., Corstjens, P. L. A. M., Pinheiro, M. C. C., da Silva, A. M., Barbosa, L., César Souza Sá, S. L., van Dam, G. J., & de Moraes Bezerra, F. S. (2025). Evaluating the efficacy of different praziquantel treatment regimens using egg and circulating anodic antigen (CAA) detection methods in a Schistosoma mansoni endemic area in northeastern Brazil. International Journal for Parasitology: Drugs and Drug Resistance, 29, 100628. https://doi.org/10.1016/j.ijpddr.2025.100628
Fordjour, F. A., & Kwarteng, A. (2025). Zoonotic schistosomiasis: The crossroads between animal and human schistosomiasis in Africa: Narrative review. Health Science Reports, 8(11), e71555. https://doi.org/10.1002/hsr2.71555
Itule, P. W., Mwanga, A., Khamisi, R. H., Byomuganyizi, M., Lutege, W., & Kagaruki, T. B. (2024). Clinical characteristics and management of patient with portal hypertension at tertial level hospital in Tanzania. BMC Cardiovascular Disorders, 24(1), 428. https://doi.org/10.1186/s12872-024-04072-x
Khedr, S. I., El Azzouni, M. Z., Ghazala, R. A., Mikhail, A. M., Okap, I. S., & Arafa, F. M. (2025). First insight into the role of the host-derived mmu-mir-214 and the parasite-derived sma-bantam as biomarkers of the Egyptian strain of Schistosoma mansoni infection before and after praziquantel treatment. Acta Tropica, 272, 107902. https://doi.org/10.1016/j.actatropica.2025.107902
Mrabet-Deraoui, I., Monforte, L., Prica, S., & Schmiedel, Y. (2025). Unexpected schistosomiasis diagnosed after appendectomy in a migrant child. American Journal of Case Reports, 26, e950906. https://doi.org/10.12659/AJCR.950906
Mulindwa, J., Lujumba, I., Musiime, C., Namulondo, J., Kimuda, M. P., Nyangiri, O., Cuu, G., Mwubaha, C., Tukwasibwe, S., Ssemaganda, A., Ssewanyana, I., Nerima, B., Baingana, R., Noyes, H., MacLeod, A., & Matovu, E. (2025). High Schistosoma mansoni infection intensity is associated with distinct gut microbiota and low levels of systemic cytokines in children along the Albert-Nile, Northern Uganda. BMC Microbiology, 25(1), 506. https://doi.org/10.1186/s12866-025-04252-5
Shankar, M., & Udayashankar, A. (2025). Heat, humidity, and hematuria: Glomerular complications of tropical infections. Glomerular Diseases, 5(1), 352-373. https://doi.org/10.1159/000547588
Sous, M., Boti, M., Mose, B., & Sous, W. (2025). Reversible paralysis in pregnancy, thinking beyond malaria: A case report. BMC Infectious Diseases, 25(1), 1644. https://doi.org/10.1186/s12879-025-12037-4
World Health Organization. (2022). WHO guideline on control and elimination of human schistosomiasis. Geneva: World Health Organization. https://www.who.int/publications/i/item/9789240041608
World Health Organization. (2022, February 22). WHO launches new guideline for the control and elimination of human schistosomiasis. https://www.who.int/news/item/22-02-2022-who-launches-new-guideline-for-the-control-and-elimination-of-human-schistosomiasis
World Health Organization. (2023, July 25). Overcoming challenges to eliminate schistosomiasis in Central Sulawesi. https://www.who.int/indonesia/news/detail/25-07-2023-overcoming-challenges-to-eliminate-schistosomiasis-in-central-sulawesi
World Health Organization. (2024, October 31). New guidance to accelerate elimination of schistosomiasis and intestinal helminthiasis. https://www.who.int/news/item/31-10-2024-new-guidance-to-accelerate-elimination-of-schistosomiasis-and-intestinal-helminthiasis
Artikel ini telah disusun berdasarkan literatur ilmiah terkini dari PubMed dan sumber-sumber resmi WHO, dengan fokus khusus pada situasi di Indonesia. Semua informasi telah diverifikasi melalui publikasi peer-reviewed dan pedoman kesehatan internasional.

Tinggalkan komentar